유전자 편집 (gene editing) 기술과 전략:
석사과정을 유전자 편집을 통한 동물 모델링까지 했지만 유전자 편집에 관한 블로그 글을 작성하려니 어디서 부터 작성해야 할지 막막했습니다.
CRISPR/Cas 시스템을 이용한 유전자 편집이라는 내용이 꽤나 방대하다는 핑계도 있었지만 ‘석사과정을 마쳤음에도 깔끔하게 내용이 정리가 안된 건가’ 라는 부끄러움이 느껴지기도 했습니다.
제 머릿속에 있는 추상적인 개념들과 노트에 적어 놨었던 정갈하지 못한 내용들을 정리하여 몇 개의 포스트를 올릴 예정입니다.
물론 제 머릿속 기억과 난잡한 기록들은 믿을만하지 못하기에 몇 개의 논문을 읽고 정리를 하였습니다.
이번 포스트에서는 CRISPR/Cas 시스템을 이용한 유전자 편집 기술들은 무엇인지 있는지. 그리고 이들의 효율성과 정확성을 높이기 위해 어떤 전략들이 연구되고 있는지 정리하였습니다.
CRISPR/Cas를 이용한 유전자 편집 기술
CRISPR/Cas9
CRISPR/Cas9 작동 원리
guide RNA가 타깃하는 DNA 부위로 이동하면서 Cas 단백질이 해당 부위를 식별합니다.
Cas 단백질이 유전자를 특정 부위에서 절단하면, 세포는 이를 수리하려고 합니다.
이때 수리 방법에 따라서 여러 결과를 볼 수 있습니다.
만일 우리가 원하는 변형된 DNA 시퀀스를 도입하여 수리 과정에서 사용하게 된다면 해당 부위에 새로운 DNA가 통합되게 됩니다.
아니면 부정확한 서열로 복구를 될 수 도 있습니다.
흔한 경우는 아니지만 이배체의 상동성을 이용해서 원래 서열로 복구가 될 수도 있습니다.
이런 방식으로 CRISPR/Cas 시스템은 특정 유전자를 편집하고 수정할 수 있습니다
CRISPR/Cas의 구조와 작동 방법은 해당 포스트(CRISPR/Cas 정의와 역사, 종류)를 확인해주세요.
CRISPR/Cas9 한계점
인간 게놈에서 정확한 유전자 편집을 수행하는 데 있어 장벽은 앞서 언급한 DNA 파손이 세포에 의해 복구되는 방식을 제어하는 것입니다.
오류가 발생하기 쉬운 NHEJ 복구가 선호 되는 경우가 많기 때문에 CRISPR-Cas로 인한 파손은 종종 유전자 파괴를 초래합니다.
HDR는 정확한 유전적 변화를 일으키며 임상적으로 바람직한 경로이지만, 이 복구 경로에는 상동성이 있는 donor 템플릿과 특정 cell cycle이 필요합니다.
DBS 상황에서 HDR를 높이기 위한 전략
CRISPR/Cas 시스템을 사용하는 목적에 따라 다르지만 유전자 편집을 수행하는데 있어서 장벽은 복구 방식을 제어하는 것입니다. 정확한 유전적 변화를 일으키기 위해 HDR을 높이기 위한 전략은 아래와 같이 있습니다.
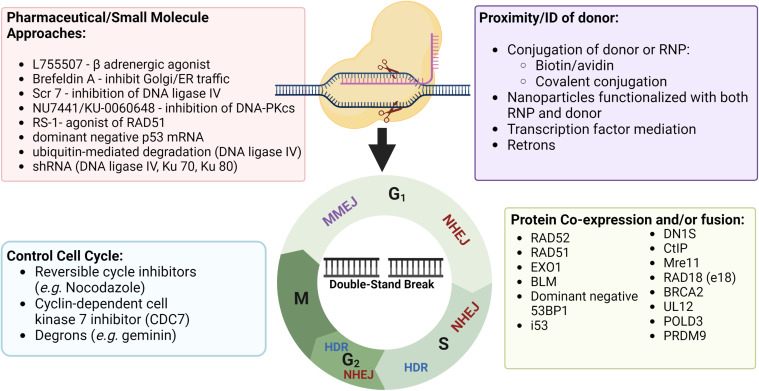
1. 약물 및 소분자를 사용한 방법: 세포 주기를 조절하거나 DNA 수리 경로를 조절하기 위해 약물이나 소분자를 사용하는 전략 .
2. Donor의 근접성 : DNA donor 템플릿의 동일성 및 유형을 최적화하고, Donor를 이중 가닥 열림 부위에 가깝게 위치시키는 전략 .
3. 세포 주기 제어: 세포 주기를 제어하여 HDR이 활발한 S/G2 단계에 세포를 유지하는 전략 .
4. 단백질 공동 발현 및/또는 융합: Cas9와 다른 단백질을 공동으로 발현하거나 융합하여 HDR을 촉진하는 전략
약물 및 소분자를 사용한 방법
NHEJ를 억제하고 HDR을 촉진하는 약물이나 소분자의 사용합니다.
몇 가지 예시로는 DNA-PKcs inhibitor, KU-0060648, SCR7, L755507 등이 있습니다
Donor의 근접성
Cas9와 donor DNA를 가까이 위치시키기 위해 Avidin과 Biotin의 상호작용을 이용하는 방법
Cas9와 donor DNA를 특정 단백질인 Rad51과 Rad52의 상호작용을 이용하여 가까이 위치시키는 방법
Cas9와 donor DNA를 특정 단백질인 THAP11과 THAP11 결합 모티브의 상호작용을 이용하여 가까이 위치시키는 방법
세포 주기 제어
Cas9를 특정 단계에만 발현 되도록 되도록 조절
Cas9를 세포 주기의 특정 단계에만 표현되도록 하는 방법으로, S, G2 단계에서 HDR이 활발히 일어나기 때문에 이러한 단계에서 Cas9를 발현시킴으로써 HDR을 촉진시키는 전략입니다.
이를 위해 Cas9를 세포 주기에 따라 조절하는 단백질과 융합시키는 방법이 연구되고 있습니다.
세포 주기 조절을 통한 HDR 촉진
세포 주기를 조절하여 HDR을 촉진시키는 방법입니다. 이를 위해 세포 주기를 조절하는 화합물이나 방법을 사용하여 HDR을 촉진시키는 연구가 진행되고 있습니다.
단백질 공동 발현 및/또는 융합
Cas9와 DNA 복구 단백질의 융합
Cas9와 DNA 복구 단백질을 융합하여 세포 내에서 DNA 복구 과정을 촉진시키는 방법입니다.
이를 통해 HDR을 촉진시키는 연구가 진행되고 있습니다 .
Base editing
Base editing 작동 원리
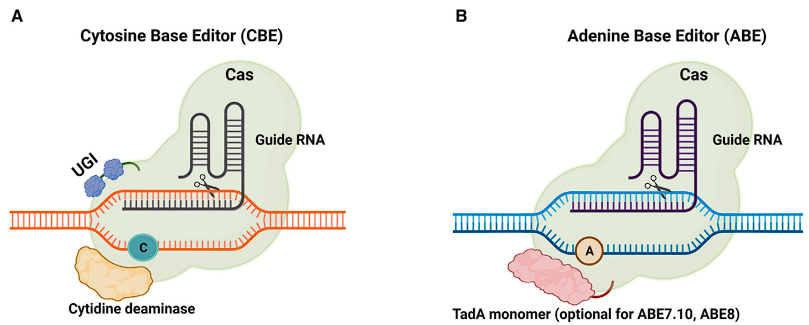
Base editing은 Cas9 nickcase에 base editing하는 단백질을 융합하여 작동합니다.
Cas9 nickcase 단백질은 일반 Cas9과 동일하게 gRNA과 복합체를 이루어서 특정 타깃을 식별합니다. 다만 일반 Cas9과 달리 DNA를 절단하지 않고 nick이라 불리는 틈만 만듭니다.
그리고 base eiditing 단백질이 특정 염기를 다른 염기로 변환합니다.
base editing 단백질은 CBE가 있고 ABE가 있습니다.
CBE는 C-G 을 T-A base pairs로 변경해 줄 수 있습니다. ABE는 A-T 염기를 G-C 염기로 변경해 줄 수 있습니다.
Base editing 한계점
특정 패턴과 매우 좁은 영역(5개 미만의 염기)에서만 염기 치환을 유도할 수 있습니다.
또한 정확히 원하는 하나의 염기만 편집하는 것이 아니라 동시에 근처의 다른 영역의 염기를 변환 할 수 있기 때문에 원하는 결과를 얻지 못할 수 있습니다.
Prime editing
Prime editing 작동 원리
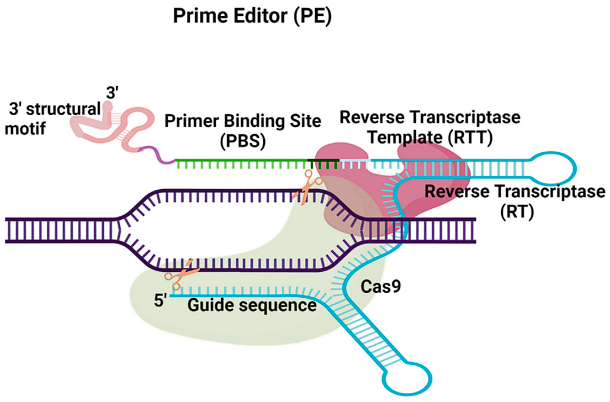
Prime Editor Complex는 한 가닥의 DNA만 절단하도록 변형된 Cas9 단백질 (Cas9 nickase)와 역전사효소로 구성됩니다
새로운 형태의 가이드 RNA인 pegRNA는 표적 유전자의 비표적 가닥에 상보적인 염기서열 (PBS ; primer binding site) 및 교정하고자 하는 염기서열을 포함하는 역전사효소의 주형가닥 부위 (RT template)를 갖습니다
pegRNA가 Prime Editor Complex를 표적부위로 안내하면, Cas9이 단일가닥의 DNA를 절단합니다
그 후, 역전사효소가 pegRNA의 RT template를 주형으로 하여 교정된 염기서열이 포함된 새로운 DNA 가닥을 합성합니다
세포 내 존재하는 엔도뉴클레아제 (endonuclease)가 오리지널 DNA 서열을 잘라내고, 유전체를 새로운 서열로 메웁니다
prime editing의 장점은 HDR을 요구하지 않고 세포 주기 의존성을 우회하지 않고도 상대적으로 작은 편집에 대한 정확한 복구가 가능하다는 겁니다.
Prime editing 한계점
prime editing은 한정적인 범위 (insertion은 ~44bp까지, deletion은 80bp까지)만 수정할 수 있는 한계가 있습니다.
primer editing을 위해 추가 단백질이 융합된 Cas9 단백질은 부피가 크기 때문에 세포 내로 운송하기가 힘든 단점이 있습니다.
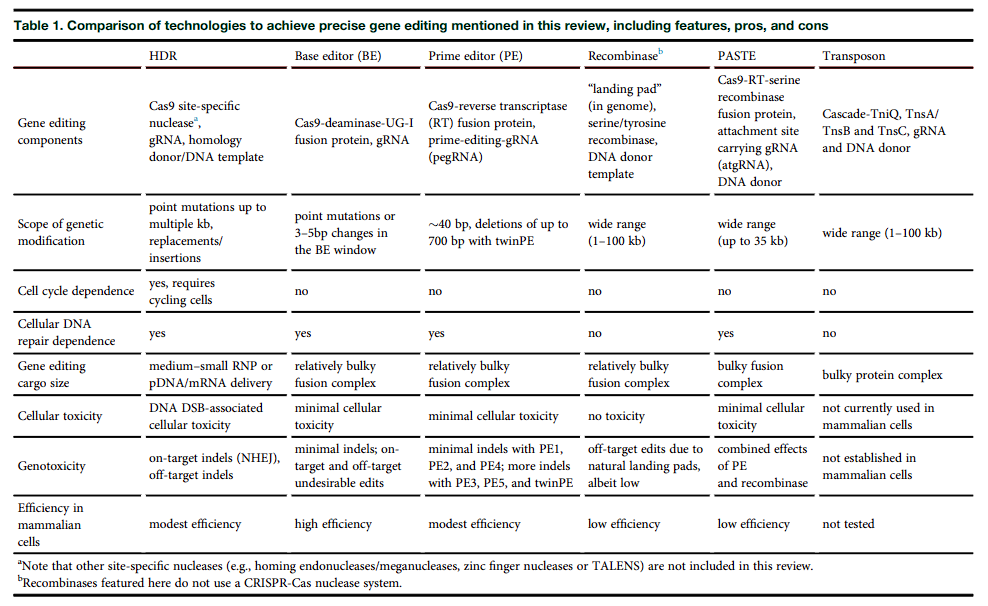
Fichter KM, Setayesh T, Malik P. Strategies for precise gene edits in mammalian cells. Mol Ther Nucleic Acids. 2023 Apr 19;32:536-552. doi: 10.1016/j.omtn.2023.04.012. PMID: 37215153; PMCID: PMC10192336.
https://pubmed.ncbi.nlm.nih.gov/37215153/
